Mới đây, Cục Quản lý Dược (Bộ Y tế) đã liên tiếp ban hành nhiều văn bản cảnh báo, ghi nhận tình trạng lưu hành thuốc giả cùng các sản phẩm mỹ phẩm có thành phần không trùng khớp với hồ sơ công bố trên thị trường.
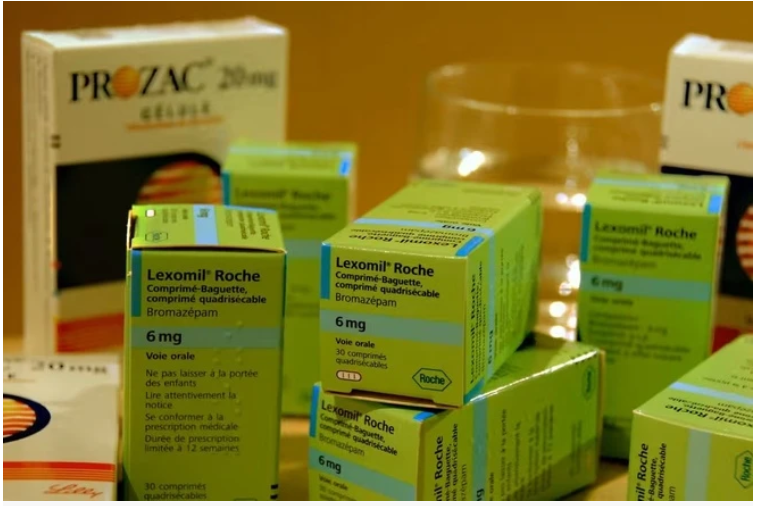
Thứ nhất, là sản phẩm thuốc ngủ liều cao Lexomil 6 mg. Qua xác minh của nhà sản xuất tại châu Âu, lô thuốc số F3193F01, hạn dùng 12/2027, bị Công an TP.HCM thu giữ là giả. Lô hàng này được sản xuất để lưu hành tại thị trường Pháp, không được nhập khẩu vào Việt Nam.

Sản phẩm nghi ngờ giả. Ảnh: Cục Quản lý Dược
Hiện nay, Lexomil 6 mg cũng chưa có số đăng ký lưu hành trong nước. Cục Quản lý Dược nhấn mạnh việc lưu hành sản phẩm này tại Việt Nam là trái quy định, đồng thời yêu cầu địa phương rà soát, truy tìm nguồn gốc để xử lý.
Trường hợp thứ hai liên quan đến Aclasta, thuốc chứa acid zoledronic thường dùng trong điều trị loãng xương và các bệnh lý về xương. Trước đó, một nhà thuốc tại Kiên Giang đã phản ánh về sản phẩm có ngày sản xuất tháng 8/2024, hạn dùng tháng 7/2027.
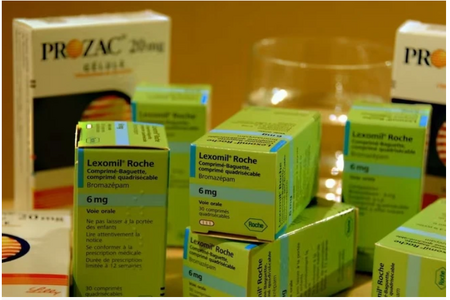
Thuốc Lexomil 6mg được lưu hành trên thị trường. Ảnh: MAXPPP.
Công ty đăng ký lưu hành khẳng định lô thuốc này không được sản xuất tại cơ sở chính thức, không do đơn vị nhập khẩu chính ngạch đưa vào. Bao bì sản phẩm cũng có điểm bất thường. Từ sau tháng 5/2024, Aclasta chính hãng không còn logo Novartis mà đã thay bằng logo Sandoz. Do đó, các sản phẩm ghi ngày sản xuất sau mốc này nhưng vẫn giữ logo Novartis bị nghi ngờ là thuốc giả.
Cảnh báo thứ ba liên quan đến nhóm thuốc nhỏ mắt, vốn được dùng phổ biến trong điều trị viêm nhiễm. Novartis Việt Nam cho biết đã nhận bốn phản hồi từ người tiêu dùng về các sản phẩm Tobrex, Maxitrol và TobraDex bị nghi ngờ làm giả.
Từ thông tin có trên bao bì và hình ảnh sản phẩm được người tiêu dùng cung cấp, Tobrex 5 ml số lô VEE90A được xác nhận chắc chắn là giả, ba lô còn lại gồm Tobrex 5 ml số lô VEE98C, Maxitrol 5 ml số lô VFD09A và TobraDex 5 ml số lô VHN07A cũng bị nghi ngờ giả mạo. Điểm chung là các sản phẩm này đều được phát hiện lưu hành bên ngoài hệ thống phân phối chính thức của công ty.
Không chỉ thuốc, lực lượng chức năng còn phát hiện thêm 6 sản phẩm mỹ phẩm không đáp ứng quy định. Công ty TNHH sản xuất và thương mại mỹ phẩm Đăng Dương buộc phải thu hồi 5 dòng sản phẩm gồm kem ngừa nám cao cấp, kem dưỡng trắng tái tạo da, kem dưỡng trắng phục hồi da, kem dưỡng trắng ngừa lão hóa và kem nám tàn nhang đồi mồi.
Tất cả đều có thành phần công thức không trùng khớp với hồ sơ công bố. Doanh nghiệp phải gửi thông báo thu hồi tới toàn bộ hệ thống phân phối, tiếp nhận sản phẩm trả lại và tiến hành tiêu hủy, đồng thời báo cáo kết quả trước ngày 15/9.
Một trường hợp khác liên quan đến Công ty TNHH MTV sản xuất dược - mỹ phẩm Gamma. Sản phẩm Vinatid (sữa rửa mặt), dù đã được cấp số tiếp nhận Phiếu công bố mỹ phẩm từ năm 2020, nay bị phát hiện công thức không khớp với hồ sơ đăng ký. Vì vậy, cơ quan quản lý yêu cầu đình chỉ lưu hành, thu hồi và tiêu hủy trên toàn quốc, đồng thời buộc doanh nghiệp phải nộp báo cáo kết quả thu hồi trước ngày 30/9/2025.
Trước tình hình trên, Cục Quản lý Dược yêu cầu Sở Y tế các tỉnh, thành phố khẩn trương kiểm tra, giám sát, thông báo tới các cơ sở kinh doanh, bệnh viện và người dân.
Đồng thời, cơ quan quản lý đề nghị tăng cường tuyên truyền để người dân chỉ mua thuốc tại các cơ sở hợp pháp, không sử dụng thuốc không rõ nguồn gốc. Các công ty liên quan như DKSH, Sandoz, Novartis... có trách nhiệm cung cấp thông tin chính xác và phối hợp trong việc truy xuất nguồn gốc lô hàng.

































































Bình luận
TVQuản trị viênQuản trị viên
Xin chào quý khách. Quý khách hãy để lại bình luận, chúng tôi sẽ phản hồi sớm