Theo nguồn tin trên báo Công an nhân dân, chiều muộn ngày 27/12, trên trang web của Bộ Khoa học và Công nghệ (KH&CN) chính thức đăng tải bản tin đính chính về “sự cố” gỡ bài liên quan đến thông tin “Bộ KIT xét nghiệm Covid-19 của Việt Nam sản xuất vừa được Tổ chức y tế thế giới chấp thuận” mà đơn vị đã đăng trước đó.
Trước đó, vào lúc 15:36 ngày 26/4/2020, bản tin “Bộ KIT xét nghiệm Covid-19 của Việt Nam sản xuất vừa được Tổ chức y tế thế giới chấp thuận” đã được đăng tải trên Cổng thông tin của Bộ KH&CN (www.most.gov.vn) và bản tin này đã được gửi tới một số phóng viên theo dõi lĩnh vực KH&CN tham khảo như thông lệ khi ngành KH&CN có sự kiện hoặc thành tựu nổi bật.
Theo Bộ KH&CN, quá trình kiểm tra lại các đơn vị chức năng nhận thấy thông tin đăng trên Cổng thông tin của Bộ KH&CN có sai sót, để có thời gian xem xét, đánh giá lại toàn bộ quá trình, bản tin đã được tạm gỡ.
Bên cạnh đó, Bộ KH&CN xin đính chính lại nội dung như sau: “Ngày 24/4/2020, WHO chấp thuận yêu cầu xin đánh giá sử dụng khẩn cấp (EUL) cho bộ kit “LightPower iVA SAR-CoV-2 1st RT-rPCR Kit” của Công ty cổ phần công nghệ Việt Á”.
Điều đáng nói, Bộ KH&CN cho rằng, lý do đăng tải thông tin trên là do trong các ngày từ 25 – 26/4/2020, một số cơ quan báo chí chính thống đã đăng tải bộ kit xét nghiệm Covid-19 của Việt Nam sản xuất vừa được WHO chấp thuận.
Bản tin “Bộ KIT xét nghiệm Covid-19 của Việt Nam sản xuất được Tổ chức y tế thế giới chấp thuận” được đăng tải trên Cổng thông tin của Bộ KH&CN trên cơ sở tổng hợp nguồn tin từ các cơ quan báo chí chính thống.
Theo nguồn tin trên Nhà báo và Công luận, trên thực tế, bản tin của Bộ KH&CN được gửi đi trước khi các cơ quan báo chí đăng tải. Và Bộ này còn gửi mail cho một số cơ quan báo chí thông tin về vấn đề trên. Các chứng cứ này vẫn còn được nhiều cơ quan báo chí lưu lại.
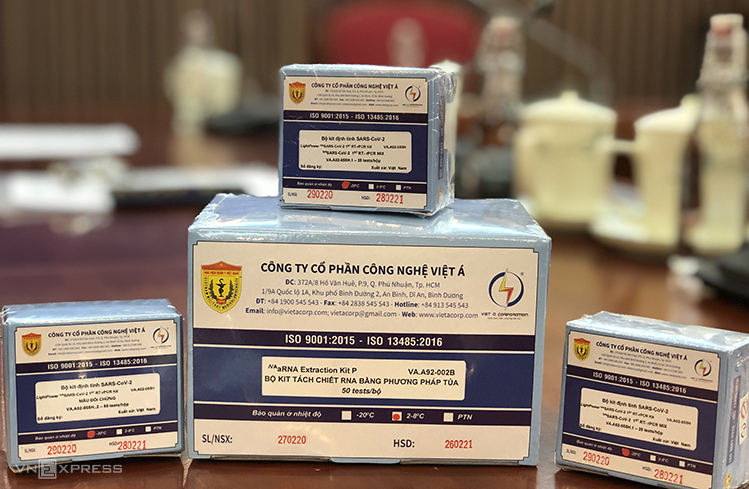
Bộ kit xét nghiệm Covid-19 của Công ty Cổ phần Công nghệ Việt Á
Như các cơ quan báo chí đã đưa tin trước đó, chiều 21/12, Bộ Y tế đã lên tiếng phản hồi xung quanh việc cấp phép lưu hành sinh phẩm xét nghiệm của Công ty cổ phần Công nghệ Việt Á.
Cụ thể, Bộ Y tế cho biết, tính đến ngày 20/12/2021, Bộ Y tế đã cấp phép 146 sinh phẩm xét nghiệm SARS-CoV-2, trong đó có 46 sinh phẩm xét nghiệm vật liệu di truyền (PCR, LAMP) tương tự như sản phẩm của Công ty cổ phần công nghệ Việt Á và Công ty cổ phần Sao Thái Dương (bao gồm 7 sinh phẩm sản xuất trong nước và 39 sinh phẩm nhập khẩu).
Bộ Y tế xác định việc cấp phép cho nhiều sản phẩm là để tăng cường nội địa hóa, chủ động nguồn cung và tạo sự cạnh tranh về giá sinh phẩm xét nghiệm. Tất cả các sản phẩm cấp phép đều đã được đánh giá đạt yêu cầu, đáp ứng tiêu chuẩn, chất lượng của Việt Nam và đảm bảo đúng theo các quy định hiện hành. Các sản phẩm sau khi được cấp phép đều được theo dõi chất lượng và tính ổn định.
Về danh mục các sinh phẩm do Tổ chức Y tế thế giới (WHO) công bố và đưa vào danh sách sử dụng khẩn cấp (EUL), các công ty mong muốn sản phẩm của mình được đưa vào danh sách của WHO thì nộp hồ sơ đề nghị WHO xem xét.
Tuy nhiên, mỗi quốc gia, tổ chức đều xây dựng tiêu chí và yêu cầu về hồ sơ, sản phẩm khác nhau về việc chấp thuận lưu hành sinh phẩm. Các công ty có nhu cầu lưu hành, sử dụng tại quốc gia và tổ chức nào sẽ nộp hồ sơ theo quy định của từng tổ chức, quốc gia đó. Do vậy, việc cấp phép của Bộ Y tế đối với sản phẩm của Công ty cổ phần Công nghệ Việt Á và các nhà sản xuất khác không phụ thuộc vào danh sách do WHO công bố.
Tính đến nay, đối với sinh phẩm xét nghiệm PCR, theo danh sách EUL của WHO có 23 sản phẩm được phê duyệt; trong khi đó, tại Châu Âu đã chấp thuận 589 loại sinh phẩm, Mỹ chấp thuận sử dụng 276 loại sinh phẩm, Hàn Quốc chấp thuận sử dụng trong nước 31 sinh phẩm...
































































Bình luận
TVQuản trị viênQuản trị viên
Xin chào quý khách. Quý khách hãy để lại bình luận, chúng tôi sẽ phản hồi sớm